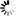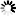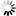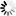甲烷是一种分子式为ch4的化合物,不仅是一种强烈的温室气体,也是一种重要的能源。它为我们的家供暖,甚至海底的微生物也生活在上面。微生物使用一种叫做甲烷厌氧氧化(aom)的过程,这种过程通常发生在海底的所谓硫酸盐-甲烷过渡区,从海底层开始,海水中的硫酸盐与更深的沉积物中的甲烷相遇。在这里,一种特殊的微生物,厌氧甲烷氧化(anme)古菌,消耗甲烷。它们与利用甲烷氧化过程中释放的电子来还原硫酸盐的细菌生活在一起。为此,这些生物形成了特征性的联系。
这一过程发生在世界各地的海底,因此是碳循环的重要组成部分。然而,由于反应非常缓慢,因此很难研究aom过程。为了进行研究,研究人员经常使用一种化学手段:甲烷中稳定的同位素比率。不幸的是,这些同位素的行为并不总是如预期的那样,导致所涉及的微生物的功能和功能严重混淆。马克斯·普朗克海洋微生物研究所、德国海洋环境研究中心marum的研究人员和以色列魏兹曼科学研究所的同事们已经解决了这一同位素问题,并在《科学进展》杂志上发表了他们的结果。这为更好地理解厌氧甲烷氧化的重要过程铺平了道路。
同位素指示反应途径
问题及其九游会体育的解决方案的详细描述:同位素是不同质量元素的不同“版本”。元素的同位素在原子核中具有相同数量的质子(带正电荷的粒子),因此它们在元素周期表中具有相同的位置(同位素=希腊语,在相同的位置)。然而,它们在原子核中中子(中性粒子)的数量上有所不同。例如,碳有两种稳定的同位素,较轻的12c和较重的13c。此外,还有常见的放射性同位素14c,这是一种非常罕见的碳,用于测定含碳材料的年龄。虽然两种稳定同位素的化学性质相同,但质量差异导致反应速率不同。
当化合物发生反应时,具有较轻同位素的化合物通常转化得更快,在初始反应物中留下较重的变体。同位素组成的这种变化被称为同位素分馏,几十年来一直被用来追踪化学反应。在甲烷氧化中,这意味着12主要消耗c-甲烷,导致剩余甲烷中的13c富集。相反,微生物产生的甲烷(甲烷生成)导致产生特别轻的甲烷。冈特·韦格纳(gunter wegener)报告称:“然而,现实却出人意料地不同。”“与上述逻辑相反,我们经常在硫酸盐甲烷过渡区发现非常轻的甲烷。”
厌氧产甲烷氧化古菌的微生物群落呈红色,其硫酸盐还原伙伴细菌呈绿色。白色刻度标记为10 m。图片来源:马克斯·普朗克海洋微生物研究所/v。
《自然》没有遵循教科书:硫酸盐甲烷过渡带中的氢甲烷
这一悖论引发了一些问题,例如:甲烷不是被消耗的,而是在那里产生的吗?如果不是大量的蚁古菌,谁应该负责?韦格纳继续说道:“在我的实验室里,我们收集了世界上最大的ane培养物,在那里我们可以尝试找出甲烷氧化剂本身是否以及如何产生轻质甲烷。”。“第一个结果是否定的:根据我们通常在海水中发现的高硫酸盐浓度,培养的微生物的行为符合教科书。剩余的甲烷富含较重的同位素。”然而,如果用较少的硫酸盐进行相同的实验,甲烷在12℃时富集并变得更轻。
硫酸盐的有效性控制aom中的同位素效应
那么他们如何解释甲烷同位素的异常行为呢?以色列魏兹曼科学研究所的乔纳森·格罗普和他的导师伊泰·哈莱维(itay halevy)花了数年时间研究微生物代谢的同位素效应,包括类似于厌氧甲烷氧化(aom)的酶催化的甲烷生成。这使他们成为不来梅队的理想九游会体育的合作伙伴。格罗普说:“这两个过程都基于一个非常相似的七个反应级联。”。“以前的研究表明,所有这些反应都可能是可逆的,即它们可以在两个方向上发生,每个反应也有自己的同位素效应。”
在该模型的帮助下,gropp可以证明,根据可用的硫酸盐,某些反应可以在不同程度上逆转。这可能会导致以下情况:重同位素并没有像往常一样被留下,而是留在反应链中,轻同位素返回到甲烷中。格罗普解释道,“微生物想要反应,但由于硫酸盐浓度低,它们受到限制。”他补充道,“我们设计的模型非常适合同位素实验。”
长时间呆在实验室和电脑前会奖励研究人员。通过他们的研究,wegener、gropp和他们的同事可以展示aom如何产生13-c缺乏的甲烷。使用少量硫酸盐的实验尤其能很好地反映微生物的自然栖息地,即海底的硫酸盐-甲烷过渡带的情况。在那里,微生物通常生长在很少的硫酸盐上,就像在低硫酸盐的实验中一样。“现在我们知道,过渡区的甲烷氧化剂可以导致甲烷中的氢同位素。甲烷的产生是不必要的。我们怀疑anme是甲烷研究的最终作者,”马库斯·埃尔伯特总结道。现在研究人员已经准备好进行下一步,并想知道其他反应是否显示出类似的同位素效应。